
2025-04-17 00:36:25
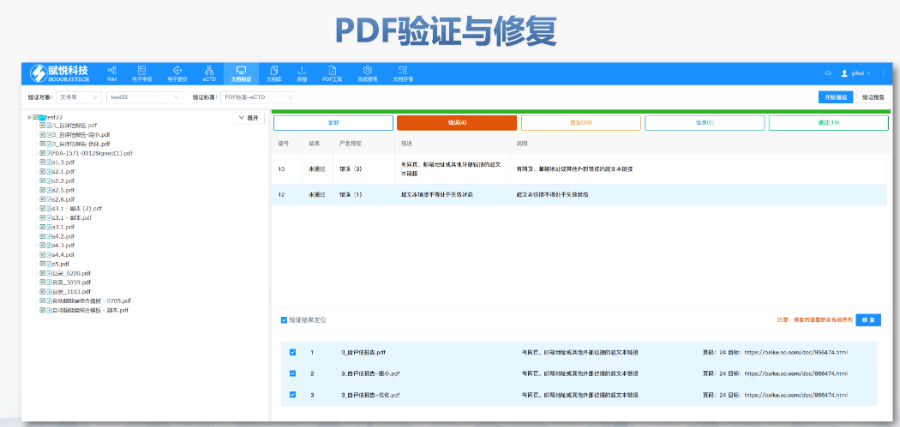
eCTD提交流程與ESG系統(tǒng):FDA要求通過電子提交網(wǎng)關(guān)(ESG)傳輸eCTD文件,單個文件大小限制為10GB,超限需拆分或通過物理介質(zhì)(如光盤)遞交。提交前需預(yù)分配申請?zhí)枺ㄈ鏝DA編號),并通過ESG測試賬戶驗證技術(shù)合規(guī)性。序列號命名規(guī)則為4位數(shù)字(如0001),申請需從“原申請”序列開始,補充資料按遞增順序編號。企業(yè)可自愿提交預(yù)審樣本(Pre-Submission),F(xiàn)DA將反饋文檔結(jié)構(gòu)、元數(shù)據(jù)等合規(guī)性問題。驗證標(biāo)準(zhǔn)與常見錯誤類型:FDA驗證標(biāo)準(zhǔn)分為高(High)、中(Medium)、低(Low)三級,高風(fēng)險錯誤(如無效XML或缺失關(guān)鍵表格)必須修復(fù),否則直接拒收。常見問題包括:重復(fù)序列號(錯誤1034)、文件路徑超長(警告2015)、PDF加密或非標(biāo)字體(錯誤4001)。2023年統(tǒng)計顯示,30%的提交因模塊1格式錯誤被退回,凸顯**信息合規(guī)的重要性。驗證工具如LORENZ eValidator被FDA官方采用,可自動檢測200+項技術(shù)指標(biāo)。瑞士eCTD驗證標(biāo)準(zhǔn)相關(guān)技術(shù)支持。江蘇CDE eCTD服務(wù)介紹
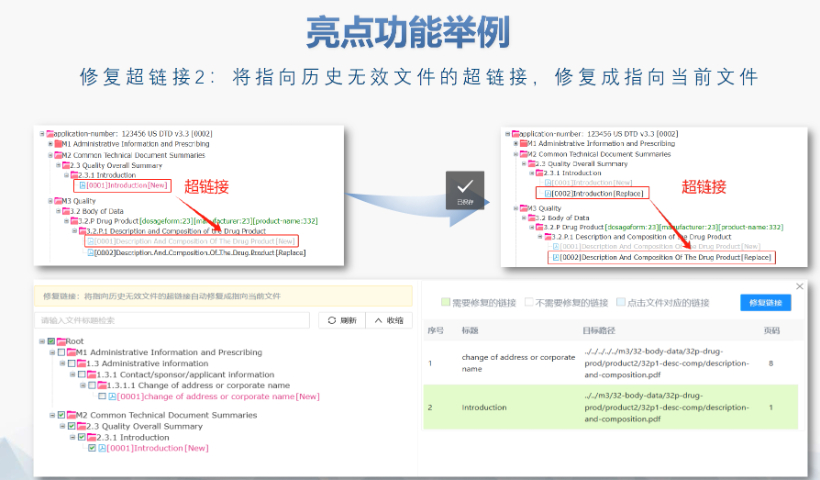
內(nèi)容與格式檢查Word預(yù)處理:需檢查拼寫、縮略語、單位格式(如),設(shè)置多級列表自動編號(如),統(tǒng)一字體(宋體/TimesNewRoman)和段落格式。重復(fù)內(nèi)容處理:相同劑型不同規(guī)格可共用模塊3,但需區(qū)分包裝系統(tǒng)(如、)。外文資料:中文在前、原文在后,參考文獻需中英文對照并建立跨網(wǎng)頁鏈接。使用符合ICH標(biāo)準(zhǔn)的eCTD編輯器自動生成XML骨架和MD5校驗值,拖拽PDF文件構(gòu)建結(jié)構(gòu)樹。序列管理:序列號從0000開始遞增,每次提交需更新序列,生命周期狀態(tài)(New/Replace/Delete)需在XML中明確標(biāo)注。驗證與遞交:確保無驗證錯誤(如書簽缺失、超鏈接斷鏈),通過ESG等電子通道傳輸,光盤封面需包含申請?zhí)柡托蛄刑枴H芷诠芾戆姹荆和ㄟ^軟件實現(xiàn)網(wǎng)頁簽入/簽出、審批流程,支持歷史版本追溯。變更管理:增補(Append)和替換(Replace)需關(guān)聯(lián)原始序列,刪除(Delete)需徹底移除無效文件。 中國澳門eCTD名稱歐盟CESP提交通道相關(guān)技術(shù)支持。
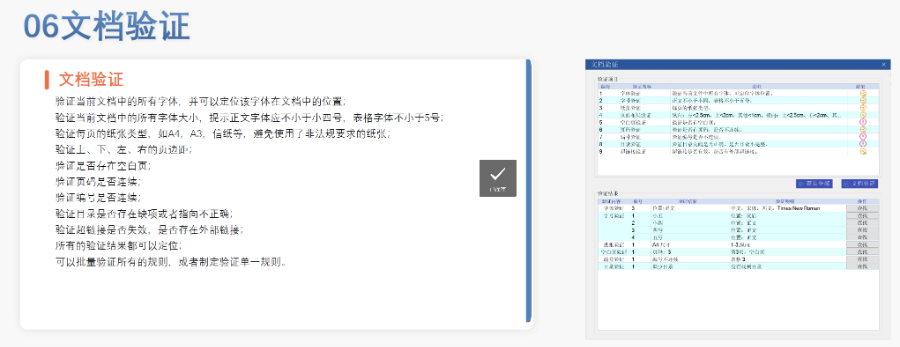
美國eCTD的強制實施時間與范圍:美國自2017年5月5日起要求藥申請(NDA)、仿制藥申請(ANDA)和生物制品許可申請(BLA)必須通過eCTD格式提交,2018年5月5日進一步擴展至臨床試驗申請(IND)和藥品主文件(DMF)。FDA通過《聯(lián)邦食品、藥品和化妝品法案》第745A條明確電子提交的強制性,豁免非商業(yè)化IND和部分DMF類型(如Ⅲ類)。2023年數(shù)據(jù)顯示,F(xiàn)DA接收的eCTD申請占比已達92%,標(biāo)志著電子化審評體系的成熟。企業(yè)若未按規(guī)范提交(如缺少us-regional.xml文件或重復(fù)序列號),將直接被拒收。
電子遞交的合規(guī)性與風(fēng)險管理 歐盟要求申請人確保電子資料與紙質(zhì)版本完全一致,若未在規(guī)定時間提交紙質(zhì)文件可能導(dǎo)致注冊終止。驗證過程中,“錯誤”級別問題(如文件命名不規(guī)范、XML邏輯錯誤)必須修正,而“警告”和“提示信息”則建議優(yōu)化以提升審評體驗。EDQM和EMA均提供驗證工具,申請人需在遞交前完成內(nèi)部預(yù)驗證。 官方費用結(jié)構(gòu)與支付流程 歐盟eCTD遞交費用因?qū)徳u程序類型而異:集中程序費用較高,涵蓋科學(xué)評估和合規(guī)審查成本;**程序費用由各成員國自行設(shè)定。CEP申請需向EDQM支付評審費,具體金額根據(jù)原料藥類型和變更復(fù)雜度分級。繳費需通過官方指定渠道完成,并附上付款憑證作為模塊1的組成部分。 多語言支持與翻譯要求 盡管歐盟允許使用英語提交,但部分成員國要求模塊一的**文件翻譯為本地語言。臨床試驗數(shù)據(jù)庫(如SDTM和ADaM)需以英語呈現(xiàn),同時提供雙語標(biāo)簽以支持多國審閱。專業(yè)翻譯服務(wù)在確保技術(shù)術(shù)語準(zhǔn)確性方面至關(guān)重要,尤其針對復(fù)雜藥學(xué)和非臨床數(shù)據(jù)。瑞士eCTD注冊外包相關(guān)技術(shù)支持。
從紙質(zhì)到電子的歷史過渡 2017年前,美國允許紙質(zhì)與eCTD并行提交,但此后逐步淘汰紙質(zhì)通道,保留緊急情況下的例外審批。2020年電子化后,所有IND、NDA、ANDA和DMF強制采用eCTD格式。 ?系統(tǒng)平臺升級 FDA通過“藥品業(yè)務(wù)應(yīng)用系統(tǒng)”和“藥品eCTD注冊系統(tǒng)”實現(xiàn)電子資料接收、受理與審評的全流程數(shù)字化。2022年系統(tǒng)增自動推送受理文書和短信提醒功能,減少人工干預(yù)。 ?電子文檔結(jié)構(gòu)優(yōu)化 美國eCTD采用分層文件夾結(jié)構(gòu),例如化學(xué)藥品的模塊1-5分別對應(yīng)**文件、總結(jié)報告、質(zhì)量數(shù)據(jù)等。2020年后增“臨床試驗數(shù)據(jù)庫”裝盒要求,強化數(shù)據(jù)可追溯性。澳大利亞ANDA注冊申報相關(guān)技術(shù)支持。福建eCTD性價比
eCTD驗證標(biāo)準(zhǔn)相關(guān)技術(shù)支持。江蘇CDE eCTD服務(wù)介紹
FDA圍繞eCTD發(fā)布了10余項法規(guī)指南,涵蓋格式要求、文件生命周期、數(shù)據(jù)**等細節(jié),其中《ICH M2 EWG》作為綜合性技術(shù)文件,成為企業(yè)申報的參考。eCTD的實施提升了審評效率,通過標(biāo)準(zhǔn)化XML結(jié)構(gòu)和電子簽章技術(shù),減少了紙質(zhì)遞交的物流與時間成本,同時支持全生命周期管理,便于后續(xù)變更和補充資料的動態(tài)更。 美國在eCTD實施中注重與ICH國際標(biāo)準(zhǔn)的兼容性,例如采用統(tǒng)一的CTD模塊化結(jié)構(gòu)和PDF技術(shù)規(guī)范。然而,其區(qū)域性要求(如信封信息中的Application ID、Submission Subtype)仍體現(xiàn)本土化特色。這種“國際框架+本地適配”的模式,既保障了跨國藥企的申報便利,又滿足了FDA的監(jiān)管需求。江蘇CDE eCTD服務(wù)介紹
<sup id="murqo"><form id="murqo"></form></sup>